
胶原探索
复合骨胶原通过调节NF-kB和MAPK信号 改善糖皮质激素诱发的骨质疏松症
朱菡1,王梦1,赵成军,李若松,杨娟1,裴广畅1,叶婷2,左学志2,刘柳1,Octavia LS Chong Lee Shin1,朱凤鸣1,孙洁2,徐虎子1,赵志1,曹楚瑾1,王玉玺1,杨倩1,徐钢1,曾锐1,姚颖1,2
华中科技大学同济医学院 同济医院 1肾脏科、2营养科,中国,湖北,武汉,解放大道1095;
3武汉和格生物技术有限公司,中国,湖北,汉阳大道630号
收到 2018.01.20 接收 2018.04.06 电子版 2018.06.15 刊出 2018.06.30
摘要:粘多糖(GAG),作为II型胶原蛋白的组成部分,其与骨代谢有着相对紧密的关系。事实证明,复合骨胶原能促进骨小梁结构的连接。然而,确切的机制尚不清楚。在本文中,我们旨在确定复合骨胶原对糖皮质激素诱发的骨质疏松的具体影响和机制。在60天内,每天用GAG灌胃。结果表明,复合骨胶原对糖皮质激素引起的骨质疏松症具有保护作用。在使用复合骨胶原治疗后,小梁的数量和连接密度增加。我们生成了骨髓来源的巨噬细胞,以探索复合骨胶原对破骨细胞分化的影响。我们收集了存在于巨噬细胞群刺激因子(M-CSF)和核因子-kB配体受体激动剂(RANKL)中的细胞蛋白和RNA,发现了复合骨胶原抑制了NF-kB和MAPK通路,从而下调破骨细胞分化分子,例如:基质金属蛋白酶(MMP 9)和活化T细胞、胞质1的核因子(NFATc-1)。我们的研究结果表明,复合骨胶原在临床环境中可能具有治疗糖皮质激素导致的骨质疏松症的治疗潜力。
关键词:糖皮质激素,骨质疏松症,复合骨胶原,NF-kB和MAPK通路
简介
慢性肾脏疾病(CKD)的特点是肾结构和各种原因引起的功能在几个月或几年的时间里逐步丧失,通常大于3个月。中国的一个现况研究显示,10.8%的中国人患有CKD;即,中国的CKD患者数量估计大约为1亿1950万人。糖皮质激素(GCs)由于其高抗炎和免疫抑制作用,是CKD患者中最常用的药物之一。然而,长期和高剂量的使用可以使患者重新出现大量的不良并发症包括糖皮质激素引起的骨质疏松症(GIOP)。
GIOP是最常见的继发性骨质疏松症,其特点是骨质疏松、骨强度降低,骨折风险增加。GCs的内源性和生理浓度对成骨细胞的分化和激活起到了积极的作用,促进了生理骨形成过程。相反,接受GCs药物治疗的患者则会经历一种非常繁琐的体验。一些对GC敏感的患者在长期和高剂量的GC治疗后甚至不能正常行走或站立,因此他们的生活质量很低。研究表明,GCs破坏了成骨细胞、骨细胞和破骨细胞活动的平衡,导致骨质疏松。成骨细胞和骨细胞数量和活动的减少或破骨细胞数量和活动的增加改变了骨形成和骨吸收之间的平衡,最终导致骨质疏松。
NF-kB通道和它的下游分子,例如MMP 9,CTSK和NFATc-1,被认为是与GIOP密切相关的关键监管机构。这些下游分子的过表达促进骨髓巨噬细胞分化成破骨细胞,从而导致骨质疏松。
II型胶原蛋白是一种主要表现在皮肤和骨骼中的蛋白质。胶原纤维,弹性蛋白和粘多糖(GAG),这些成分相互交织形成一个与骨密度相关的网状结构,从而增加骨的质量和强度。特别是GAG,被用作是测量II型胶原蛋白和骨代谢的重要标志。然而,相关机制尚不清楚。
在这项研究中,我们旨在确定在破骨细胞生成过程中,复合骨胶原对骨骼过程的影响。复合骨胶原抑制了GC引起的骨质疏松症,该骨质疏松症是通过NF-kB和MAPK通道促进破骨细胞相关分子MMP 9、CTSK和NFATc-1,导致的破骨细胞分化。复合骨胶原抑制GCs-介导破骨细胞生成,通过这种方式抑制了GC诱发的骨质疏松症。
原料和方法
制备纯复合骨胶原溶液
通过复合骨胶原片剂(武汉和格生物技术有限公司)制备复合骨胶原溶液。片剂溶解于蒸馏水中浓度为10%(10g/100ml);PH值调制7.0。最后,该溶液通过防细菌过滤器过滤,以保持无菌。
动物和处理
雄性C57bl/6小鼠(8周大,重25g)是从北京华富康实验动物技术有限公司(北京,中国)购买的。在同济医学院动物护理病房,动物们适应了特定的无病原体(SPF)条件下的居住环境。动物被保存在22摄氏度的温度环境中,有12 h/12 h的光/暗周期,持续10周,直到4.5个月大。从美国的Innovative Research(IRA,佛罗里达,美国)购买了安慰剂和氢化泼尼松缓释球团。动物被随机分为四个实验组:正常组(没有特殊的干预),安慰剂组(给小鼠皮下植入7.5mg的安慰剂,60天缓释),氢化泼尼松组(给小鼠皮下植入7.5mg的氢化泼尼松,60天缓释),GAG组(给小鼠皮下植入同等剂量的氢化泼尼松缓释团,同时给其灌胃复合骨胶原溶液);每组6-8只小鼠。我们选择的是总剂量为7.5mg,释放期为60天的球团做研究。通过注射1%的戊巴比妥钠(0.008ml/每克身体重量)使小鼠麻醉。然后,在肩胛骨上方创建合适的地方来植入缓慢释放安慰剂和氢化泼尼松的球团。手术后,复合骨胶原溶液的剂量为每克身体重量0.45mg/day。60天后,颈椎脱位处死小鼠。我们在60天后没有发现任何的球团。手机股骨、胫骨和血液做进一步分析。所有的实验程序都是按照国家卫生研究院的指导方针进行的,并得到同济医院动物保护和使用委员会(ACUC)的批准。
骨形态参数
通过显微计算机断层扫描(μ-CT50,Scanco医疗,巴瑟尔斯多夫,瑞士)分析了左胫骨的骨形态参数和显微结构特征。胫骨近端采用内置软件进行三维重建,小梁参数包含骨体积/总体积比(BV/TV),小梁数量(Tb.N),小梁厚度(Tb.Th),小梁空间(Tb.Sp),骨面积/骨体积比(BS/BV),以及连通性密度(Conn.D)。
病态骨着色
将股骨固定于4%多聚甲醛溶液中2天。然后在0.5 M ETDA(PH=8.0)溶液中进行3周的脱钙处理并嵌入进石蜡中。石蜡嵌入的股骨被分成5μm个部分,用伊红(H&E)着色,并在显微镜(奥林巴斯,日本)下观察。
免疫印迹分析
在液氮中粉碎骨组织,并在含有蛋白酶抑制剂混合物(促进剂,武汉,中国)和苯甲基磺酰氟(促进剂,武汉,中国)的RIPA裂解缓冲液(促进剂,武汉,中国)中均质化。以同样的方式收集细胞蛋白。按照制造商的指示用BCA试剂盒测定总蛋白的浓度(促进剂,武汉,中国)。蛋白质被SDS-PAGE分离并转移至PVDF膜(密理博,比勒利卡,MA, 美国)。这些膜在0.1%至20的TBS中被5%的脱脂牛奶阻断1小时,37℃。然后对OPG抗体进行探测(稀释1:1000,Bioworld, 中国),RANKL(稀释1:1000,ProSci Inc., 美国),MMP 9(稀释1:1000,Abcam, 英国),NFATc-1(稀释1:1000,Abcam, 英国),CTSK(稀释1:1000; Abcam,英国),总磷-65,-38,-ERK,-JNK(稀释1:1000,细胞信号技术,美国)和GAPDH(稀释1:4000, Abbkine, 中国)在4摄氏度下持续一整晚。第二天印迹被洗掉,在37℃下用共轭HRP二级抗体培育1小时,通过化合光可视化增强(ECL, BioRad, 美国)。使用ImageJ分析目标带的灰值(NIH, 美国)。
细胞培养
从4周龄的雄性C57bl/6小鼠中分离得到原发性骨髓单核细胞。用培养液冲洗股骨和胫骨,然后采集骨髓细胞到直径10厘米的盘中。在含10%胎牛血清的α-MEM媒介中进行细胞培养(FBS),100 U /mL青霉素,100 U /mL链霉素和30 ng/mL的巨噬细胞集落刺激因子M-CSF(PeproTech,Rocky Hill,新泽西)。24小时后,在M-CSF存在下收集漂浮细胞,继续培养3天。粘附细胞作为骨髓源性巨噬细胞(BMMs)以待进一步使用。BMMs保持在潮湿的培养器中(热科学,美国),37℃,5% CO2,95%大气。培养液每两天补充一次。
细胞活性测量
细胞计数kit-8(促进剂,武汉,中国)被用来评估细胞活性。把BMMs培养在密度为5 × 103的96格孔板中的每格孔板中。在细胞粘附后,用不同浓度的复合骨胶原(GAG: 0, 0.0015, 0.0075, 0.015,0.15, 1.5 g/L)和地塞米松(DXM: 0,0.001, 0.01, 0.1, 1 μM)治疗细胞96小时。然后用10% CCK-8的完全培养液代替细胞培养液。在37℃下孵化1-4小时,用多模式读取器测量450nm处的吸光度。
TRAP着色
为了检测破骨细胞的分化,BMMs暴露于100 ng/mL的RANKL(PeproTech,Rocky Hill,新泽西)和30 ng/mL的M-CSF。用不同浓度的复合骨胶原(0,0.0015, 0.0075, 0.015, 0.15, 1.5 g/L) 和地塞米松(0.1 μM) 对细胞进行治疗96小时,然后根据制造商的指示用4%多聚甲醛固定,并用抗酒石酸性磷酸酶着色(TRAP)。(酸性磷酸酶,白细胞(TRAP)Kit, Sigma, 美国)。TRAP阳性细胞被认为是破骨细胞并计数。
RNA制备和逆转录酶-聚合酶链锁反应
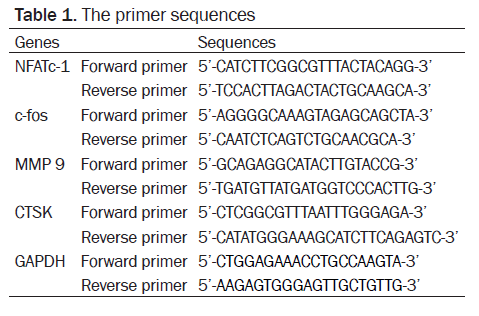
根据制造商的指示,用试剂盒从破骨细胞中提取总核糖核酸(Invitrogen, 美国)。在20μL反应系统中,一个微观的RNA通过GoScript逆转录系统(Promega, 美国)被反向转录成第一个链cDNA。使用循环参数如下:40个周期PF变性,在95度下15秒和60度下热处理60秒。对每个样品 进行了重复3次试验。使用荧光试剂混合(试剂盒,德国)在瑞士罗氏480II灯下做定量PCR反应。通过比较周期阈值(Ct)方法测定MMP 9, CTSK, NFATc-1和RANKL等破骨细胞相关标志物的Mrna表达水平,并进行规范化至GAPDH表达水平。PCR反应引物序列见表1。
表1. 引物序列
统计分析
在目前研究中所有数据被报道是用平均数± 标准差比较法在两组间使用非成对或非参数的Mann-Whitney测试完成的。所有数据均采用SPSS 18.0和GraphPad Prism 5.0软件进行分析。P<0.05被认为是有意义的。
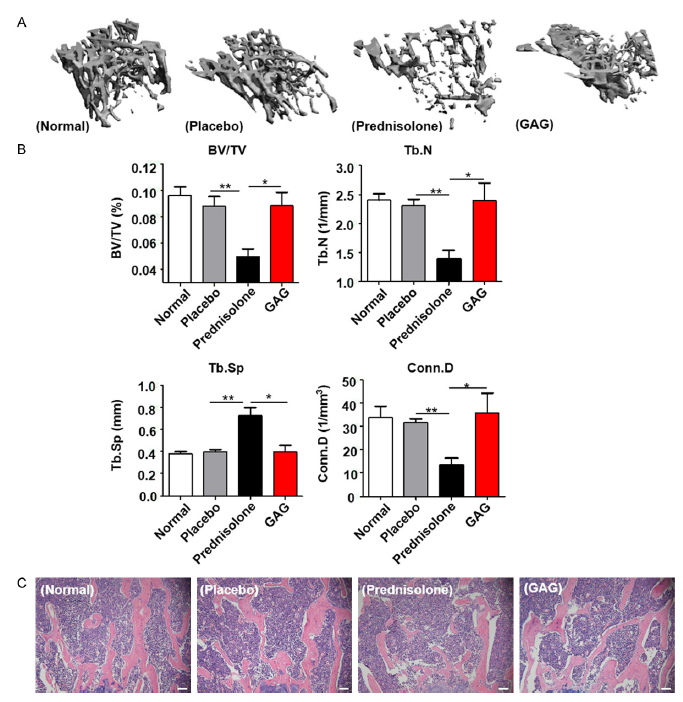
图1 复合骨胶原对GIOP小鼠骨微结构的影响。小鼠被皮下植入60天缓释7.5mg安慰剂丸或氢化波尼松丸,复合骨胶原灌胃。
A:从正常组、安慰剂组、氢化波尼松组和复合骨胶原组用微CT分析下的胫骨近端的三维重建。
B:微ct分析近端胫骨的参数直方图:相对骨体积与总体积比(BV/TV);小梁数目(Tb.N);小梁的空间(Tb.Sp);连接密度(Conn.D)。
C:在不同组中股骨H&E染色的代表图像,比例尺为20 μm。数据表示为平均数±标准差,n=5-7/组。治疗组和控制组的差异具有统计意义,结果显示为*P<0.05, **P<0.01。
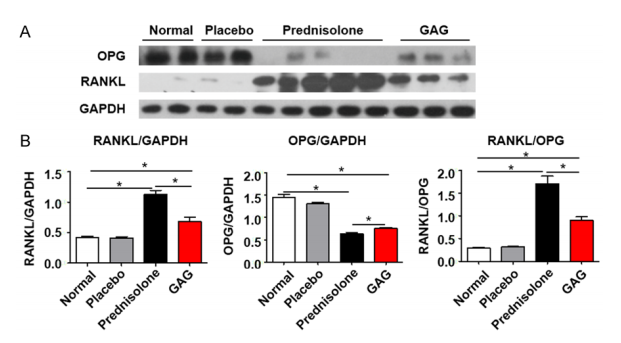
图2 复合骨胶原抑制GIOP小鼠RANKL/OPG比率的表达。
A .GIOP小鼠中RANKL 和OPG的蛋白免疫印迹分析。
B.柱状图显示氢化波尼松导致了RANKL /OPG信号通路的激活,因此促进了糖皮质激素引发的骨质疏松(GIOP)。复合骨胶原减轻骨组织中RANKL /OPG比率,从而保护小鼠免于GIOP。所有结果显示均值± SD, n=3-5/group, *P<0.05。
结果
在GIOP小鼠体内,复合骨胶原对骨骼微结构的影响
通过显微CT观察左胫骨骨微结构。采用3D重建技术来直接评估骨骼结构和骨密度。通过分析包含BV/TV, Tb.N, Tb.Sp和Conn.D的骨小梁参数来计算骨骼微结构。与正常组和安慰剂组对比,在3D重建中氢化波尼松组显示明显的骨流失(图1A)。在测量BV/TV, Tb.N 和 Conn.D.时显示明显的下降。复合骨胶原治疗组,BV/TV, Tb.N 和Conn.D.参数显著增长,且骨小梁间的间距减少(图1B)。在胫骨H&E着色中也显现了同样的结果(图1C)。复合骨胶原改善了由脱氢皮质醇导致的骨小梁流失。同时,以上结果显示氢化波尼松降低骨密度(BMD)并使骨小梁微结构稀疏,这从而导致小鼠更容易发生骨折。通过增加骨小梁和强化骨微结构,复合骨胶原可以保护小鼠免于GCs导致的骨流失。
复合骨胶原影响GIOP小鼠的RANKL/OPG表达。
为了探究复合骨胶原对糖皮质激素引发骨质疏松的抑制作用的可能的潜在机理,我们首先检查了生物化学标记血清钙(Ca2+)和血清磷酸盐。与正常组和安慰剂组对比而言,用氢化波尼松球团小组显示出低浓度的血清钙离子。复合骨胶原加强了血清钙离子的浓度。然而,血清磷酸盐并没有明显差异。接下来,我们对胫骨和腿骨中的RANKL和OPG的蛋白质水平进行了评估(图2A),RANKL和它的诱骗受体OPG是调节骨吸收和骨形成平衡的2个重要分子。RANKL表达的增加或是OPG表达的减少会导致破骨细胞进一步分化和活跃[12,13]。在GIOP小鼠中,非常有趣的是氢化波尼松诱发了RANKL的严重过表达,而非OPG的表达(图2B)。在复合骨胶原组中RANKL的增强表达和OPG的抑制表达均得到了缓解。
复合骨胶原抑制了BMMs中破骨细胞的分化。
接下来将研究BMMs对GCs、复合骨胶原和骨质疏松之间的关系。地塞米松,复合骨胶原影响了BMMs的抗毒性(图3A)。显著的是从0μM到 1μM地塞米松组剂量依赖破骨细胞分化(图3B)。TRAP+细胞的数量和区域随地塞米松的增加而增加(图3C)。当增加复合骨胶原时,TRAP+细胞的数量和区域下降且无细胞毒性(图3D和3E)。因此,GCs促进了破骨细胞的分化和发育,但是受复合骨胶原的影响得到抑制。
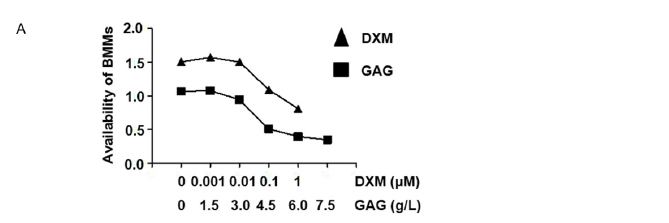
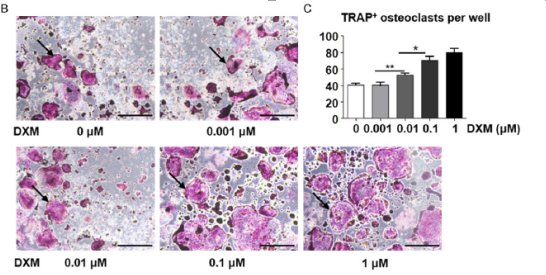
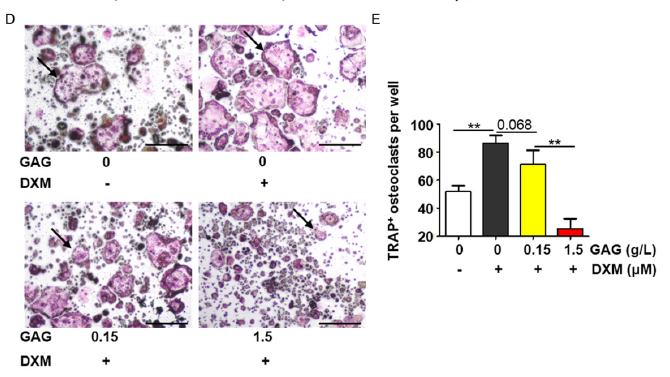
图3 在BMMs中,复合骨胶原抑制破骨细胞的分化。
A.对于BMMs可用性上,地塞米松和复合骨胶原的不同浓度。
B.4天的地塞米松(0, 0.001, 0.01, 0.1,1μM)和RANKL (100 ng/ml)的BMMs的TRAP着色。箭头表明TRAP+多核破骨细胞。
C. 每孔中TRAP+细胞数量。显示数据的平均值± SD, n=3.
D. 4天的地塞米松(0.1 μM),复合骨胶原(0, 0.0015, 0.0075, 0.015, 0.15, 1.5 g/L)和RANKL (0.1 μM)的BMMs的Trap着色。箭头显示TRAP+多核破骨细胞。
E. 每孔中TRAP+细胞数量。显示数据的平均值± SD, n=3 *P<0.05; **P<0.01. 基准尺: 500 μm.
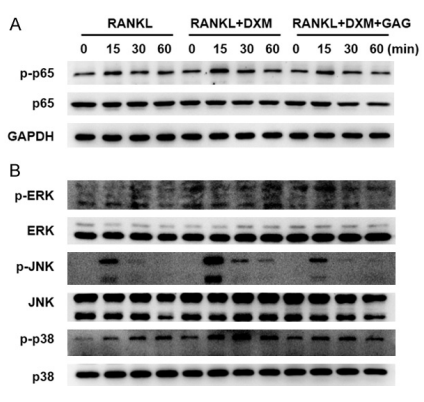
图4 复合骨胶原抑制RANKL诱发的NF-kB and MAPK通路。BMMs用M-CSF (30 ng/ml)培养,细胞用地塞米松共同培养,使用或不使用复合骨胶原培养24小时,之后用RANKL (100 ng/ml) 刺激细胞 0 分钟,15 分钟, 30 分钟和 60分钟。用蛋白免疫印迹来测量数种基因中蛋白质水平。
A.在15分钟时 p65 (p-p65)磷酸化表达增加,经地塞米松刺激后的1小时内减少。在复合骨胶原组中,p-p65总体水平降低。
B.MAPK通路亚科(p-ERK, p-JNK, p-p38)呈现与p65磷酸化表达相似的趋势。
复合骨胶原抑制RANKL诱发的NF-kB 和 MAPK通路。
考虑到NF-kB通路在RANKL促进破骨细胞分化中扮演着重要的角色,因此,我们下一步调查复合骨胶原对RANKL诱发NF-kB 和 MAPK通路活性的效果。如图4所示的通路,在15分钟时,复合骨胶原抑制了由地塞米松诱发的磷酸化p65的增长。在MAPK通路中,显示出了同样的效果。磷酸化p38的增长证实,在RANKL存在的ERK 和 JNK的地塞米松组,受复合骨胶原的抑制影响。
复合骨胶原抑制了破骨细胞分化的相关重要分子的表达
最终,我们发现,地塞米松组中NF-kB和MAPK通路有增长。这是由复合骨胶原抑制的结果。这个结果提示我们去检查它的下游信号分子NFATc-1和c-fos。由蛋白质印记和逆转录聚合酶反应分析得出复合骨胶原显著的抑制了NFATc-1 和 c-fos的表达。接下来我们检查了测到的NFATc-1、靶向的MMP 9 and CTSK。并发现,复合骨胶原在他们的表达中起着抑制的作用。地塞米松激活了下游基因NFATc-1, c-fos, MMP 9和CTSK,结果促进了破骨细胞分化和骨质疏松的发展。然而,复合骨胶原通过抑制GCs诱发的破骨细胞分化从而抑制了这一效果(图5)。
讨论
在中国复合骨胶原被认为是健康的食品,且它们对提高骨质量和骨强度的作用为大众熟知。在切除卵巢的小鼠中,复合骨胶原加强了股骨生物力学指数,如最大的负荷量、抗压力和弹性模量。然而,它们对于GIOP的作用不详。本次研究主要专注于复合骨胶原对GIOP小鼠的作用。已公认,GCs的内源性和生理剂量调节成骨细胞分化并最终抑制破骨细胞的活性来维持骨形成和骨吸收的平衡。过多的GCs有着相反的作用,它将妨碍骨骼体内平衡并导致骨质疏松[15]。因为高剂量的GCs治疗会导致继发性骨质疏松,这限制了他们的临床应用。RANKL是一个至关重要的因子,它调节GIOP中破骨细胞的分化和活性。与受体RANK结合,RANKL开始补充适当的分子,如:TRAFs, 尤其是 TRAF-6,接着激活下游NF-kB信号通路,从而调节NFATc-1和它的靶向基因MMP 9和 CTSK的表达,这样就促进了破骨细胞的分化和骨质疏松[16]。RANKL或RANKL/OPG比率的表达的增加改变了骨骼体内平衡,最终导致骨质疏松[17, 18]。RANKL的减少减弱了破骨细胞分化和骨吸收过程。以前的研究表明了RANKL对破骨细胞分化的抑制作用(OPGFc蛋白、RANKL抑制剂狄诺塞麦),主要是绝经后骨质疏松[12, 19]。在这次研究中,我们证实,氢化波尼松治疗的小鼠RANKL和 RANKL/OPG比例的减少,可能解释了GIOP中复合骨胶原的保护作用。
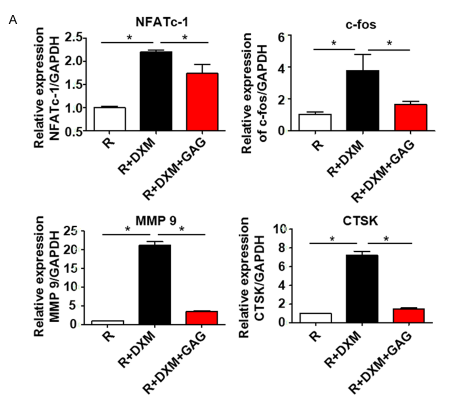
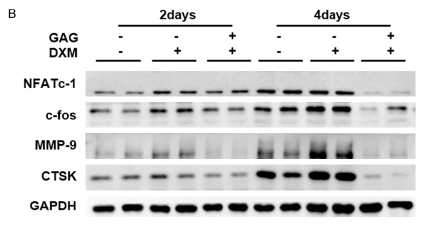
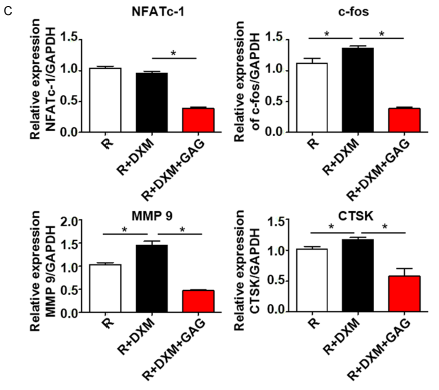
图5 复合骨胶原抑制与破骨细胞分化相关的重要分子的表达。BMMs在RANKL (100 ng/ml) 和M-CSF(30 ng/ml)中培养。在不同组中加入地塞米松(0.1 μM)或复合骨胶原(1.5 g/L),细胞培养2或4天。几个基因的mRNA的表达由RT-PCR量化。蛋白质含量由免疫印迹检测。
A.数个标记转基因水平的RTPCR分析与NF-kB 和 MAPK信号通路相关联。
B.NFATc-1, c-fos,MMP 9, CTSK的蛋白表达免疫印迹分析。显示数据的平均值± SD, n=3。
C.NFATc-1, c-fos, MMP 9和CTS的定量标准化到GAPDH. *P<0.05。
NFATc-1是钙调磷酸酶和Ca2+管控的转录因子,受RANKL诱发明显。在破骨细胞生成期间,RANKL 与 RANK的结果导致了NFATc-1通过NF-kB信号通路时的脱磷酸作用。因此,细胞核移位,加强了破骨细胞关联基因如MMP 9和CTSK的转录与翻译。因此影响了破骨细胞的分化和骨质疏松[20, 21]。MMP 9是一种酶,属于锌-金属蛋白酶家族,涉及ECM降级。在骨组织中,MMP 9由破骨细胞生成,有着降级和改变骨骼中ECM的能力。因此,参与骨吸收和骨重建生理及病变过程[22, 23]。作为溶酶体的半胱氨酸蛋白酶,主要在破骨细胞中表达。CTSK也能够引诱ECM降级。CTSK不足会导致骨质疏松为特征的致密度成骨不全症紊乱[24]。
我们证实复合骨胶原是通过抑制RANKL/OPG通路保护小鼠免于GIOP。复合骨胶原治疗组的骨小梁数量及连接性有提高。我们进一步观察发现在RANKL存在的情况下,复合骨胶原治疗BMMs时,磷酸化-65和-38的表达减少。同时,曾使用复合骨胶原治疗的BMMs中发现向下调节下游分子NFATc-1, c-fos, MMP 9 和CTSK。体内OPG表达的增加和RANKL表达的减少以及体外NF-kB 与MAPK信号通路的抑制,清晰的表明复合骨胶原是通过NF-kB和MAPK信号通路使小鼠免于GIOP。RANKL表达的减少和OPG表达的增强抑制了NF-kB和MAPK信号通路,因此影响了NFATc-1和c-fos的转录,最终导致MMP 9 和 CTSK的向下调节。结果是,破骨细胞分化和ECM降级得到缓解,因此改善了GC诱发的骨质疏松。
在这个研究中,我们证实了GCs对破骨细胞分化的重要影响。复合骨胶原通过NF-kB和 MAPK信号通路抑制GC诱发的骨质疏松。GCs在药理学剂量诱发骨质疏松不仅仅是破骨细胞的结果,同时也是成骨细胞和骨细胞的结果[25]。过多的GCs抑制成骨细胞的分化和增值,同时促进了成骨细胞的凋亡[26]。先前的研究显示抑制成骨细胞分化和增值与Wnt信号向下调节β-连环蛋白和RUNX2转录因子的减少息息相关[27]。另一个重要的调节者是BMP2,它被证实在曾接受药理学剂量GCs的小鼠中被抑制了。β-连环蛋白,RUNX2 或BMP2的减少导致造骨新生的减少和MSCs向脂肪细胞分化[28]。此外,治疗剂量的GCs诱发骨细胞自我吞噬和凋亡,同时也减小了骨细胞的生存能力[8, 29]。促凋亡激酶的活化或骨细胞中的自噬体的产生,细胞毒性环境的创造,导致细胞凋亡和死亡。然而,是否是骨细胞中的自我吞噬的抑制削弱了GIOP还有待研究[30]。
总而言之,我们的研究清晰的表明复合骨胶原对糖皮质激素诱发的骨质疏松具有保护作用。相关联的机理是RANKL表达的减少以及NF-kB和 MAPK通路的抑制有关。这项研究为临床环境减弱GIOP提供了一些理论基础和潜在疗法。然而,还需要进一步的研究来评估复合骨胶原对成骨细胞或骨细胞影响,及进一步探索潜在的保护效果的分子机制。
感谢
本项工作由中国国家自然科学基金会(补助金81570669, 81200521, 81570615)和武汉卫生和计划生育委员会(补助金grants 2016whzqnyxgg02)提供支持。
揭露利益冲突
无
以上为中文译文,英文原版,欢迎大家进入网站英文版阅读,如有翻译不当,欢迎联系我们,多多指教。
以上内容为营养科普知识,仅供消费者参考学习。相关内容不代表产品功效,请消费者理性阅读。
