
胶原探索
骨质疏松性骨折愈合过程中Ⅰ,Ⅱ型胶原蛋白表达与其力学性能
Correlations between type Ⅰ and Ⅱ collagen expressions and mechanical strength in osteoporotic fracture healing
Yuan Shao-hui, Liu Wei, Wu Bin-qi, Han Xi-guang, Bo Chao-gang
Abstract
BACKGROUND: Studies have demonstrated that osteoporosis is a complex pathophysiological process involves changes of type Ⅰ collagen number and physical or chemical properties. However, reports addressing correlations between type Ⅰ and Ⅱ collagen expression are few.
OBJECTIVE: To disclose the change rules of type Ⅰ and Ⅱ collagen protein during osteoporotic fracture healing in rats and the correlation of them with mechanical strength.
METHODS: Rats were randomly divided into osteoporotic fracture and general fracture groups. Rats in the former group received ovariectomy. The expressions of type Ⅰ, Ⅱ collagen were observed by Western blot at 1, 2, 4, 5, 8 and 12 weeks. The bone mineral density was examined by dual-energy X-ray absorptiometry, and biomechanical testing were performed at 4, 8, 12 and 16 weeks postoperatively.
RESULTS AND CONCLUSION: There were significant differences between the osteoporotic fracture group and general fracture group in type Ⅰ and Ⅱ collagen expression and bone mineral density at different time points after injury (P < 0.05). With the injury time prolonged, the downward trend was more obviously. The type Ⅰ and Ⅱ collagen were correlated with maximum torque, elastic modulus, and maximum torsion angle in the osteoporotic fracture group (P < 0.05). The results showed that abnormal secretion of type Ⅰ and Ⅱ collagen osteoporotic fracture healing decreases mechanical strength and reduce the quality of fracture healing, which is the main reason for re-fracture.
Yuan SH, Liu W, Wu BQ, Han XG, Bo CG. Correlations between type Ⅰ and Ⅱ collagen expressions and mechanical strength in osteoporotic fracture healing.Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu. 2011;15(2): 208-212.
[http://www.crter.cn http://en.zglckf.com]
摘要
背景:研究显示骨质疏松症是涉及Ⅰ型胶原数量及理化性质改变的一种复杂病理生理过程,但有关骨质疏松与Ⅰ,Ⅱ型胶原间的相关性,至今少有报道。
目的:观察骨质疏松性骨折愈合中Ⅰ,Ⅱ型胶原蛋白表达的变化规律,及其与生物力学性能的相关性。
方法:将大鼠随机分为骨质疏松性骨折组与一般性骨折组。骨质疏松性骨折组切除卵巢建立骨质疏松模型。分别于骨折损伤后 1,2,4,5,8,12 周采用Western blot 方法检测骨痂中Ⅰ,Ⅱ型胶原的蛋白表达,于损伤后 4,8,12,16 周进行骨密度测定与生物力学性能测试。
结果与结论:骨质疏松性骨折组Ⅰ,Ⅱ型胶原的表达及骨密度值在损伤后各时间点与一般性骨折组相比均差异有显著性意义(P < 0.05),且随着损伤时间的延长,下降趋势更明显。骨质疏松性骨折组中Ⅰ,Ⅱ型胶原与最大转矩、弹性模量、最大扭转角均有相关性(P < 0.05)。结果显示,骨质疏松性骨折愈合过程中Ⅰ,Ⅱ型胶原的分泌异常改变导致了其力学强度乃至骨折愈合质量的降低,影响骨折愈合,是再次骨折发生的主要原因。
关键词:胶原;骨质疏松;骨密度;生物力学;骨组织工程
doi:10.3969/j.issn.1673-8225.2011.02.005
袁绍辉,刘伟,吴滨奇,韩希光,薄超刚. 骨质疏松性骨折愈合过程中Ⅰ、Ⅱ型胶原蛋白表达与其力学性能[J].中国组织工程研究与临床康复,2011,15(2):208-212. [http://www.crter.org http://cn.zglckf.com]
0 引 言
骨质疏松症以低骨量和骨组织微结构破坏
为特征,其最严重的后果是发生骨质疏松性骨折。目前常用的骨质疏松评价指标包括骨密度、骨代谢生化指标、骨生物力学强度及骨小梁显微结构。实验在建立骨质疏松性大鼠骨折模型的基础上,以骨有机质即骨Ⅰ,Ⅱ型胶原为主要研究对象,观察大鼠骨质疏松性骨折骨痂愈合过程中骨胶原含量变化规律,以及其变化与生物力学强度变化的相关性,从而为骨质疏松骨折的诊断与治疗提供理论依据。
1 材料和方法
主要仪器及试剂:
| 试剂及仪器 | 来源 |
| Fax itron 样本放射系统 | 美国Itron 公司 |
| AG-I 生物力学测量系统 | 日本岛津公司 |
| DPX2L 型双能 X 射线骨密度仪 | 美国Lunar 公司 |
| WDS2100 型计算机电子万能力学试验系统 | 日本松下公司 |
| SPECTRAMAX 190 连续光谱微孔板光密度测量仪 | 美国MDC 公司美 |
| Gel Doc2000 图像分析系统 | 国Bio-Rad 公司 |
| 鼠抗人Ⅰ,Ⅱ型胶原单克隆抗体 | 美国Invitrogen 公司 |
| 兔抗鼠IgG | 美国Santa Cruz 公司 |
实验方法
分组与建模:将50只大鼠随机分为骨质疏松性骨折组与一般性骨折组,每组25只。各组动物在腹腔注射麻醉
(氯氨酮 0.1 g/kg)后,大鼠的呼吸心跳平稳后将其固定于操作手术台上,脱毛后消毒。骨质疏松性骨折组开腹后切除双侧卵巢后缝合,一般性骨折组开腹后切除少量脂肪组织后缝合。
术后3个月,所有实验动物在麻醉下,建立两组骨折模型:骨质疏松性骨折组骨折模型和一般性骨折组骨折模型[2]。取两组大鼠股外侧切口,经股前、外侧肌群, 标准号髓腔逆行内固定。全部实验小鼠于术后当日立即使用Fax itron样本放射系统拍摄X射线片并判断建模成功与否[3]。
Western blot 法检测Ⅰ,Ⅱ型胶原蛋白表达:两组动物分别于骨折损伤后1,2,4,5,8,12周处死[4-5],每个时相点3只,骨痂在-80 ℃ 条件下保存直待标本备齐。将骨折标本置于200 g/L 的乙二胺四乙酸中4 ℃下脱钙
1周。取脱钙骨组织按组织裂解法提取蛋白,用Bradford法测定蛋白浓度[6]。
骨痂中Ⅰ,Ⅱ型胶原蛋白表达的Western blot免疫印记分析:蛋白先进行10%聚丙烯酰胺凝胶电泳,转膜,取出硝酸纤维素薄膜置入20 g/L 牛血清白蛋白/PBST 液中37箱过夜,Ⅰ型胶原一抗为鼠抗人Ⅰ型胶原单克隆抗体(1∶1 500),二抗为兔抗鼠IgG(1∶2 000)。Ⅱ型胶原一抗为Ⅱ型胶原单克隆抗体(1∶200),次日漂洗硝酸纤维素薄膜3次,5 min/次,再加入适当稀释的二抗,室温2 h,取出再次漂洗3次,5 min/次,ECL显色,X射线胶片曝光显影。
检测Ⅰ,Ⅱ型胶原表达时各时相点均取5个骨折端蛋白样本进行检测。将X射线胶片置于Gel Doc2 000图
像分析系统。测定目的条带的平均吸光度值,并将5次实验结果的平均值作为蛋白含量的相对值。
骨痂组织的骨密度测定:于骨折实验模型建立后的4,8,12,16 周每组各处死4只大鼠[7],摘取股骨标本在
DPX2L 型双能X射线骨密度仪下以股骨骨痂为中心,扫描2 cm阶段。测试完毕后,用生理盐水湿纱布包敷,塑料袋密封后置于-20 ℃冰箱中,以备力学测试使用。
力学性能测试:将已进行骨密度测定的股骨标本自
-20 ℃冰箱中取出逐级解冻,并在室温下自然复温,板厚千分尺测量股骨长度与骨痂矢状径、横径,并计算两组伤后不同骨折愈合时间相应骨痂组织横状经和骨痂截面积。
于骨痂边缘侧选3 mm×4 mm的骨表面,粗砂纸使骨表面平坦、粗糙,体积分数100%丙酮表面脱酯,干燥后进行测定。用WDS2100型计算机电子万能力学试验系统进行三点弯曲试验。承载点跨距为30 mm,加载点取胫骨中点,加载速度为2 mm/min。胫骨两端用方形骨水泥固定,防止加载时胫骨旋转,保持各标本位置一致,检测时保持标本湿润状态,进行股骨扭转强度测试,测量两组骨痂组织最大转矩、弹性模量(g×cm2/deg) 和最大扭转角(deg/cm)。
主要观察指标:两组伤后Ⅰ,Ⅱ型胶原蛋白的表达
及其与伤后骨密度与生物力学性能(最大转矩、弹性模量、最大扭转角)之间的相关性。
统计学分析:计量资料用x±s表示,用SPSS13.0 统
计软件包对数据进统计学分析处理。Ⅰ,Ⅱ型胶原表达水平之间的显著性检验采用两样本t 检验;计算每对标本的力学参数比率,组间差异判断用方差分折法,Ⅰ,
Ⅱ型胶原与最大转矩、弹性模量、最大扭转角间的相关性分析采用线性回归法,P < 0.05为差异有显著性意义。
结果
2.1实验动物数量分析 纳入大鼠50只均进入结果分析,无死亡和感染,无脱落。
2.2Ⅰ,Ⅱ型胶原的表达 见图1和表1。
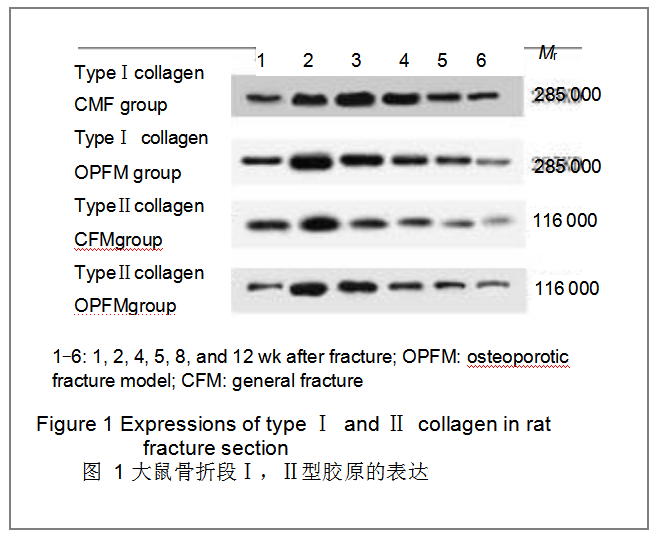
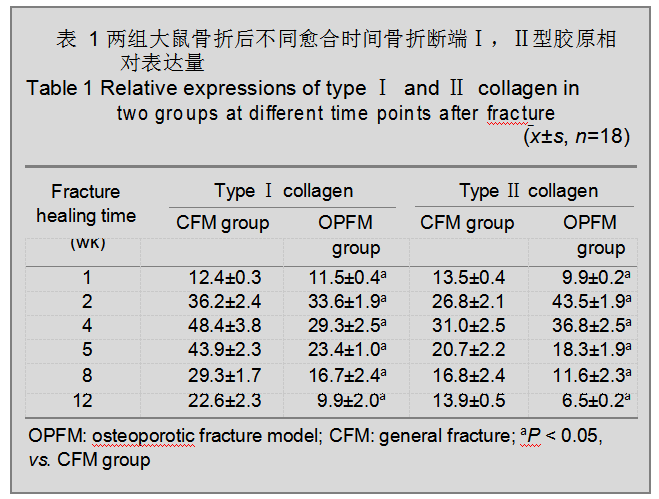
骨质疏松性骨折组Ⅰ,Ⅱ型胶原的表达在损伤后各时间点与一般性骨折组相比均差异有显著性意义(P <
0.05),且随着损伤时间的延长,下降趋势更明显。
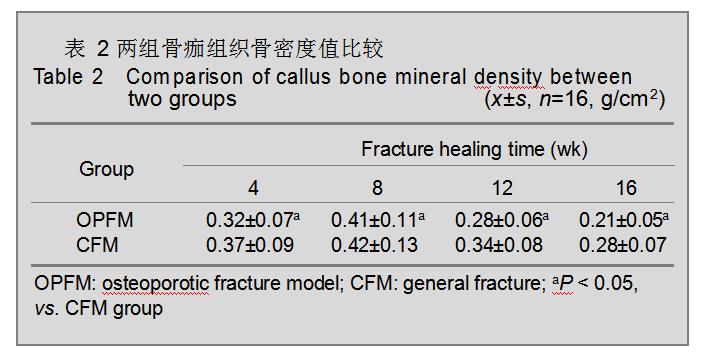
骨痂组织的骨密度变化 两组骨密度值在骨折实验模型建立术后的4,8,12,16 周均低于一般性骨折组(P < 0.05);两组均在8周时达高峰,随后降低;16周时骨质疏松性骨折组骨密度下降最明显(P < 0.05),见表2。
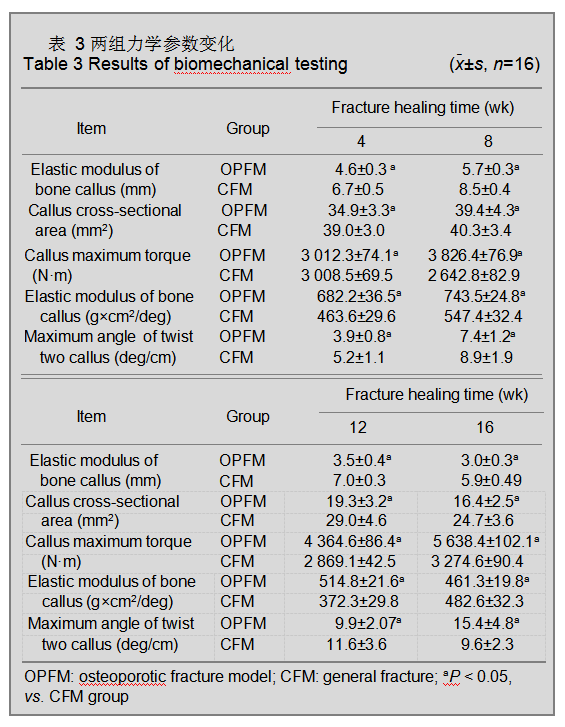
生物力学测定结果 两组骨痂组织横状径及骨痂截面积均在骨折后8周达高峰(P < 0.05),随后逐渐下降,但骨质疏松性骨折组均较一般性骨折组高(P <
0.05)。
两组骨痂组织最大转矩在骨折后4周差异较小,
8~12周一般性骨折组逐渐上升,骨质疏松性骨折组在第
8周有所下降后在第12,16周逐渐上升,并低于一般性骨折组(P < 0.05)。
两组骨痂组织弹性模量均在骨折后第8周均达到高峰,第12~16周逐渐下降,骨质疏松性骨折组各时间段均低于一般性骨折组(P < 0.05)。
骨质疏松性骨折组痂组织最大扭转角在骨折后第
4~12周均高于一般性骨折组(P < 0.05),第12周达高峰后,第16周明显下降,低于一般性骨折组(P < 0.05), 一般性骨折组第4~16周持续上升,第16周两组间差异有显著性意义(P < 0.05)。
两组的力学参数具体变化见表3。
2.5骨质疏松性骨折组骨痂组织中Ⅰ、Ⅱ型胶原与骨痂组织力学参数相关性分析 将骨质疏松性骨折组各数据进行正态性检验,均为正态性分布,再行直线相关性分析,结果显示:骨质疏松性骨折组中Ⅰ型胶原与最大转矩、弹性模量和最大扭转角相关系数r 值分别为
0.812,0.848和0.604 (P < 0. 05);Ⅱ型胶原与最大转矩、弹性模量和最大扭转角相关系数r 值分别为0.759,
0.807和0.586 (P < 0. 05)。骨质疏松性骨折组骨痂组织横状径、截面积、最大转矩、弹性模量及最大扭转角之间均呈明显的线性回归关系。
讨论
骨基质包括有机质和无机质。有机质主要为胶原纤维(主要为Ⅰ,Ⅱ型胶原纤维)和少量的无定型基质,无机质即骨盐,为结晶的羟磷灰石和无定型的胶体磷钙。胶原纤维是组成骨构架和维持骨的力学强度的基质蛋白。骨形成即骨矿化是无定型的磷酸钙及其它骨盐规律的沉积在骨有机质间隙内的过程,骨胶原是骨矿化的核心。去卵巢大鼠模型是目前公认为与临床最接近的绝经后骨质疏松动物模型[8]。雌激素可促进成骨细胞Ⅰ型胶原、碱性磷酸酶和转化生长因子β等的合成和分泌, 从而促进骨形成[9]。大鼠双侧卵巢切除后雌激素合成和分泌减少,使成骨细胞骨胶原合成减少,分解代谢加快, 使骨吸收大于骨形成进而导致骨量的丢失和骨生物力学强度的降低,最终致骨质疏松症[10]。
3.1Ⅰ型胶原在大鼠骨质疏松性骨折及正常骨折愈合过程中的表达规律 实验发现,骨质疏松性骨折组Ⅰ型胶原在骨折后第2周达峰值,迟于一般性骨折组,且峰值低于后者,在骨折后第8周起Ⅰ型胶原值开始回落, 并在各时间段均低于一般性骨折组。以往研究认为,骨质疏松是以骨无机质减少,骨量下降,脆性增加为特征的全身性代谢骨病[11]。研究表明,骨质钙盐减少所致的骨量丢失,可致骨密度降低,骨小梁稀疏变细,但是骨生物力学参数并未明显的降低,单纯骨钙降低并不能很好的解释骨质疏松患者易于发生骨折这以一现象[6]。但其峰值点低于一般性骨折组,同时在峰值后的各时间段内,Ⅰ型胶原的含量均低于一般性骨折组,说明骨质疏松组织中骨基质中有机质形成因子的减少[12-13],导致胶原的合成峰达到过早和提前衰落,细胞功能亢进转为抑制, 成骨细胞的活性受到影响,由成骨细胞分泌的Ⅰ型胶原量减少,骨痂钙化、骨化遇到延缓,Ⅰ型胶原是促成骨细胞分化和增强成骨细胞黏附能力主要因素[8],是成骨细胞表型成熟和钙结节形成的形成骨机械力量的基本保障,是组成骨构架的基质蛋白。Ⅰ型胶原数量的改变,势必导致骨痂的骨矿钙化延迟。实验结果表明Ⅰ 型胶原的蛋白表达量显著低于正常骨折组,胶原纤维合成减少,为骨矿化提供框架的机械支持功能降低,使得钙盐等无机质无法沉积矿化,最终使骨吸收增加。
3.2Ⅱ型胶原在大鼠骨质疏松性骨折及正常骨折愈合过程中的表达规律 实验发现两组的Ⅰ,Ⅱ型胶原的蛋白表达随骨折愈合时间变化也呈现由低表达到高表达, 再回落到低表达,峰值与低值对应的时间点两组相同:
Ⅰ型胶原两组峰值在伤后4周;Ⅱ型胶原两组峰值在伤后2周。区别在于各时间点尤其是在峰值点上表达量差异有显著性意义。说明骨质疏松性骨折愈合中Ⅰ,Ⅱ型胶原的分泌规律与正常骨折愈合规律是一样的,但其表达量的差异将可能是导致骨质疏松性骨折不同临床愈合结局的原因之一[14-15]。
实验结果提示,骨质疏松性骨折愈合过程中Ⅱ型胶原峰值达到时间较早,可能是由于在骨质疏松性骨折愈合早期软骨细胞功能亢进,释放大量Ⅱ型胶原, 这与临床中发现伴有骨质疏松性骨折断端处早期可以见到大量的软骨性骨痂相吻合[16]。伤后第4周Ⅰ型胶原量达高峰后,机体成骨细胞的活性受到影响,其分泌量减少, 骨痂钙化、骨化遇到延缓,实验结果表明Ⅰ型胶原的蛋白表达量显著低于正常骨折组,临床表现为骨折断端骨化差,愈合质量差,生物力学性能不佳。
大鼠骨质疏松性骨折及正常骨折愈合过程中骨密度的变化 骨密度常作为全面评价骨质疏松骨强度和预测骨折危险性的一个可靠指标,大量的动物实验和临床研究的结果表明单纯骨密度增加,骨质量全未必增加,反而降低,因此骨的生物力学测试是评价骨质量最
有说服力的指标之一。实验采用了具有高度的精确性与灵敏性的双能X射线骨密度仪进行骨痂骨密度检测。实验结果显示,两组骨密度值在各时间段(骨折实验模型建立术后的4,8,12,16周)均低于一般性骨折组;两组均在8周时达高峰,随后降低;16周时OPFM 组骨密度下降最明显。由于大鼠在骨折愈合过程中软骨痂数量高于人类,使得软骨痂的矿化及吸收的程度与速度对骨量的影响较显著。有学者研究报导,骨质疏松性骨折愈合早期时镜下观察软骨痂内肥大软骨细胞数量增多,而外径最大,表明范围广、矿化充分的软骨痂决定了骨密度数值增高。至8周时,成熟的矿化软骨痂渐被吸收,被幼稚小梁骨取代,外径迅速缩小导致了骨密度下降;同时雌激素下降导致骨转换率(负平衡)增高,成熟小梁骨被大量吸收、移除也是骨密度下降的原因之一[17-18]。
3.4Ⅰ,Ⅱ型胶原在大鼠骨质疏松性骨折及正常骨折愈合过程中与生物力学相关指标间的相关性 骨折部位的结构强度和刚度取决于骨痂的物质特性(强度和模量)和断面几何形状(断面面积和惯性运动) , 骨痂的力学和生化特性更类似于未成熟的密质骨。骨的愈合过程即骨的结构和生物力学特性的恢复。测定骨的力学性能变化是评判骨折愈合进展的最直接方法。研究表明骨折的刚度增强可达到最大弯曲强度的2倍,如果骨折刚度恢复到原来状况时,强度为未损伤时的一半。由于力学性能测定在临床应用难以实现,近年来,国内外学者致力于研究一种无创的可量化的方法来监测和评估骨愈合的进程,包括测定骨损害部位的骨量及骨密度、刚度、骨痂的量及骨代谢变化等。骨折端组织的机械强度和刚度是愈合的指标已被普遍接受。对骨折愈合的力学性能检测,以往大多采用拉伸试验与弯曲试验(如三点弯曲、四点弯曲等)。有学者认为,骨结构的变化对骨组织力学性能的影响远较骨量更重要[19-20]。实验结果提示,骨质疏松性骨折愈合的骨痂组织横状径、截面积、最大扭转矩及其弹性模量在各个愈合时间段内基本低于一般性骨折组,而骨痂组织的最大扭转角虽然在愈合的12周内高于一般性骨折组,但在16周时明显低于一般性骨折组,说明由于骨折愈合的骨痂组织中有机质含量的差异,导致骨质疏松性骨折组的骨痂组织其力学性能降低,因而临床工作中仅依靠X射线摄片或骨密度检查, 并非能全面、客观地反映骨质疏松性及骨折愈合程度。实验结果示,骨质疏松性骨折组中Ⅰ,Ⅱ型胶原均与骨痂组织的最大转矩和弹性模量呈高度直线相关,与骨痂最大扭转角呈中度直线相关,提示骨质疏松性骨折由于骨胶原含量减少,为骨矿化提供框架的机械支持能力降低,使钙盐等无机质无法沉积矿化,骨折愈合的骨痂的生物力学强度下降,其与骨胶原含量下降有直线相关性。骨胶原数量减少和质量下降是造成骨质疏松性骨折再骨折发生的主要原因。
综上所述,骨质疏松性骨折的生物力学强度下降,其骨胶原的变化是骨质疏松骨生物力学改变的主要原因,通过提高骨胶原的含量及质量来改善骨质的生物力学性能,可有效降低再骨折的发生率。
参考文献
[1]The Ministry of Science and Technology of the People’s Republic of China. Guidance Suggestions for the Care and Use of Laboratory Animals. 2006-09-30.
[2]She C, Dong QR, Zhou XZ. Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu. 2008;12(46):9071-9075.
佘昶,董启榕,周晓中.大鼠股骨开放截骨模型与闭合骨折模型制作的比较[J].中国组织工程研究与临床康复,2008,12(46):9071-9075.
[3]Zhang LF, Qi J, Wang JZ, et al. Zhongguo Jiaoxingwaike Zazhi. 2010;18(2):143-146.
张连方,齐进,王晋申,等.小鼠闭合性股骨骨折模型的建立与评估[J]. 中国矫形外科志,2010,18(2):143-146.
[4]Ma C, Gou SH, He F, et al. Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu. 2008;12(50):9978-9981.
马骋,苟三怀,何仿,等.大鼠胫骨骨折愈合过程中Ⅰ、Ⅱ型胶原蛋白的表达:失神经状态下Western blot方法测定[J].中国组织工程研究与临床康复,2008,12(50):9978-9981.
Möbius W, Cooper B, Kaufmann WA, et al. Electron microscopy of the mouse central nervous system. Methods Cell Biol. 2010;96:475-512.
[6]Aosibo FM, Buluntt R, Kimstom RE, et al. Original. Jin YX, Yan ZY, Wang HL, et al. Tanslation. Beijing: Science Press. 1998.
F 奥斯伯,R 布伦特,E 金斯顿,等.精编分子生物学实验指南[M].金由辛,颜子颖,王海林,译.北京:科学出版社,1998.
[7]Xu SW, Wang JW, Li W, et al. Zhonghua Yixue Zazhi. 2004;84(14): 1205-1210.
徐少文,王建卫,李伟,等.骨质疏松对大鼠胫骨骨折愈合质量的影响
[J].中华医学杂志,2004,84(14):1205-1210.
[8]Uppel ME, Miller LM, Burr DB. The effect of the microscopic and nanoscale structure on bone fragility. Osteoporos Int. 2008;19(9):
1251-1265.
[9]Chen D, Wang LT, Chen ZY, et al. Zhongguo Guzhi Shusong Zazhi. 2002;8(3):208-210.
陈东,王连唐,陈子怡,等.去卵巢后大鼠不同部位的骨组织计量学与骨密度研究[J].中国骨质疏松杂志,2002,8(3):208-210.
[10]Gong YS, Chen J, Zhang QZ, et al. Effect of 17beta-oestradiol and ginsenoside on osteoporosis in ovariectomised rats. J Asian Nat Prod Res. 2006;8(7):649-656.
[11]Caporaso F, Frisch F, Sumida KD. Compromised Bone Health in Non-Obese, Older Women with Low Caloric Intake. J Community Health. 2010;23(11):772-781.
[12]Wuertz K, Godburn K, Iatridis JC. MSC response to pH levels found in degenerating intervertebral discs. Biochem Biophys Res Commun. 2009;379(4):824-829.
[13]Yang X, van der Kraan PM, van den Dolder J, et al. STRO-1 selected rat dental pulp stem cells transfected with
adenoviral-mediated human bone morphogenetic protein 2 gene show enhanced odontogenic differentiation. Tissue Eng. 2007; 13(11):2803-2812.
[14]Anakwe RE, Aitken SA, Khan LA. Osteoporotic periprosthetic fractures of the femur in elderly patients: outcome after fixation
with the LISS plate. Injury. 2008 39(10):1191-1197.
[15] Gardner MJ, Nork SE, Huber P, et al. Less rigid stable fracture fixation in osteoporotic bone using locked plates with near corticalslots. Injury. 2010;41(6):652-656.
[16]Ogawa K, Hori M, Takao R, et al. Effects of combined elcatonin and alendronate treatment on the architecture and trength of bone in ovariectomized rats. J Bone Miner Metab. 2005;23(5):351-358.
[17]Georgescu CE, Mihai A, Didilescu AC, et al. Cone beam computed tomography as a method of quantitative and qualitative analysis of alveolar crest in the frontal mandibular area. Rom J Morphol Embryol. 2010;51(4):713-717.
[18]Grases F, Sanchis P, Prieto RM, et al. Effect of tetracalcium dimagnesium phytate on bone characteristics in ovariectomized rats. J Med Food. 2010;13(6):1301-1306.
[19]Alwood JS, Yumoto K, Mojarrab R, et al. Heavy ion irradiation and unloading effects on mouse lumbar vertebral microarchitecture, mechanical properties and tissue stresses. Bone. 2010;47(2): 248-255.
[20]Mousny M, Omelon S, Wise L, et al. Fluoride effects on bone formation and mineralization are influenced by genetics. Bone. 2008;43(6):1067-1074.
来自本文课题的更多信息
基金资助:课题受黑龙江省教育厅科学技术研究项目基 金(11531149)资助。
作者贡献:袁绍辉进行实验设计。实验实施为袁绍辉、 刘伟、吴滨奇和韩希光。实验评估为袁绍辉和刘伟。资料收集为韩希光和薄超刚。袁绍辉成文、审校及对文章负责。
致谢:对参与本次实验部分工作和提供实验技术性帮助 的哈尔滨医科大学附属第一医院中心实验室表示感谢。
利益冲突:课题未涉及任何厂家及相关雇主或其他经济 组织直接或间接的经济或利益的赞助。
伦理批准:实验对动物的处理方法符合中华人民共和国 科学技术部颁发的《关于善待实验动物的指导性意见》。
本文的创新点:对骨质疏松性骨折愈合过程中胶原蛋白 的表达规律及其与生物力学性能之间的相关性的研究还相对较少,现有文献仅停留在多种胶原蛋白在骨质疏松骨基质中的表达或某单个胶原蛋白在骨质疏松性骨折愈合过程中的表达。作者查阅大量文献后尚未见到Ⅰ,Ⅱ型胶原蛋白在骨质疏松性骨折愈合过程中的表达规律及其临床意义。实验采用分子生物学技术研究了骨质疏松性骨折愈合中Ⅰ,Ⅱ型胶原蛋白表达的变化规律,及其与生物力学性能的相关性。与国内外同类研究水平的比较,实验在技术和研究结果层面上创新性的体现了骨质疏松性骨折愈合过程中Ⅰ,Ⅱ型胶原蛋白的表达规律,及其与骨折生物力学性能直接的相关性。

“以上内容为营养科普知识,仅供消费者参考学习。相关内容不代表产品功效,请消费者理性阅读。”
