
胶原探索
Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响
蒋 萍,蔚 芃,赵明才,陈 琼,王 梓(川北医学院附属医院骨科,四川省南充市 637000)
蒋萍,女,1983 年生,四川省南充市人,汉族,2012年川北医学院毕业,硕士, 医师,主要从事骨与关节损伤修复研究。
通讯作者:蔚芃,主任医师,川北医学院附属医院骨科,四川省南充市637000
文章亮点:
1.胶原蛋白作为天然高分子生物材料已被证实可作为软骨组织工程支架材料,并且它作为底物能刺激软骨细胞生长,可用于体外软骨细胞培养,但关于不同类型胶原蛋白刺激成软骨作用的能力仍存在争议。
2.实验创新性使用Ⅰ、Ⅱ型胶原包被培养板和普通培养板同时培养人软骨细胞,研究Ⅰ、Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响。发现胶原蛋白包被培养板培养软骨细胞优于普通培养板,其中Ⅱ型胶原蛋白包被培养板在培养软骨细胞时更能维持细胞形态,延长去分化现象出现的时间,更利于细胞再分化。
关键词:
生物材料;软骨生物材料;Ⅰ型胶原蛋白培养板;Ⅱ型胶原蛋白培养板;人软骨细胞;体外培养
主题词:
胶原Ⅰ型;胶原Ⅱ型;软骨细胞
基金资助:
四川省卫生厅项目
摘要
背景:实验证明胶原蛋白底物具有刺激成软骨的作用,但关于不同类型胶原蛋白刺激成软骨作用的能力仍存在争议。
目的:观察Ⅰ、Ⅱ型胶原蛋白对体外培养人软骨细胞生物学特性的影响。
方法:将 P3 代人软骨细胞分别加入普通培养板、Ⅰ型胶原蛋白包被培养板、Ⅱ型胶原蛋白包被培养板继续培养。培养 10 d 内,MTT 法绘制细胞生长曲线;培养 28 d 后,采用 ELISA 法、聚合酶链反应、二甲基亚甲基蓝比色等方法检测 3 种培养板中软骨细胞分泌Ⅰ胶原蛋白、Ⅱ型胶原蛋白及糖胺多糖的量。
结果与结论:Ⅱ型胶原蛋白包被培养板中软骨细胞数量最多,增殖速度为Ⅰ型胶原蛋白包被培养板的 2 倍、
普通培养板的 5 倍。Ⅱ型胶原蛋白包被培养板中软骨细胞分泌Ⅰ型胶原蛋白最少,与普通培养板板检测结果差异有显著性意义(P < 0.01),与Ⅰ型胶原蛋白包被培养板检测结果差异无显著性意义;Ⅱ型胶原蛋白包被培养板中软骨细胞分泌Ⅱ型胶原蛋白、糖胺多糖最多,与其他两种培养板检测结果差异有显著性意义(P < 0.01)。表明胶原蛋白包被培养板培养软骨细胞优于普通培养板,其中Ⅱ型胶原蛋白包被培养板在培养软骨细胞时更能维持细胞形态,延长去分化现象出现的时间,更利于细胞再分化。
蒋萍,蔚芃,赵明才,陈琼,王梓.Ⅰ、Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响[J].中国组织工程研究,
2014,18(30):4845-4850.
Effect of type I or type II collagen on biological characteristics of human chondrocytes
Jiang Ping, Master, Physician, Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China
Corresponding author: Wei Peng, Chief physician, Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China
Accepted: 2014-05-21
Jiang Ping, Wei Peng, Zhao Ming-cai, Chen Qiong, Wang Zi (Department of Orthopedics, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, Sichuan Province, China)
Abstract
BACKGROUND: Experiments have shown that the collagen substrate has the capability of stimulating cartilage generation, but the stimulating role of different types of collagen substrates remains controversial.
OBJECTIVE: To investigate the effect of type I and type II collagen on the biological characteristics of human chondrocytes cultured in vitro.
METHODS: Human chondrocytes at passage were cultured onto the ordinary culture plates (ordinary plate), type I collagen-coated culture plates (type I plate), and type II collagen-coated culture plates (type II plate). Cell growth curves were determined by MTT method after cells were cultured for 10 days. By ELISA, PCR, and 1,9-dimethyl methyleneblue technology, type I and type II collagen and glycosaminoglycan contents were quantitatively detected in cartilage cells 28 days after culture.
RESULTS AND CONCLUSION: The number of cartilage cells was the highest in type II plate, which was twice of that in type I plate and five times of that in ordinary plate. Cartilage cells in type II plate secreted the least amount of type I collagen, which showed significant differences compared with the ordinary plate (P < 0.01) and had no statistically significant difference with type I plate (P > 0.01). Cartilage cells in type II plate secreted the most amount of type II collagen and glycosaminoglycan, showing significant differences compared with the other two plates (P < 0.01). The cartilage cells cultured in collagen plates are better than that cultured in ordinary culture plate, type II collagen culture plate is better than type I collagen culture plate in maintaining cell shape, extending the dedifferentiation pattern, and promoting cell differentiation.
Subject headings: collagen type I; collagen type II; chondrocytes
Funding: a grant by Sichuan Provincial Health Ministry
Jiang P, Wei P, Zhao MC, Chen Q, Wang Z. Effect of type I or type II collagen on biological characteristics of human chondrocytes. Zhongguo Zuzhi Gongcheng Yanjiu. 2014;18(30):4845-4850.
引言
随着组织工程学的发展,软骨组织工程学为人们提供了更为理想的修复关节软骨缺损方法。如何获得大规模具有增殖活性的种子细胞为当前面临的最大限制因素之一。
1994年Brittberg[1]体外培养患者健康软骨细胞,获得大量纯化软骨细胞,再移植到其关节软骨缺损部位治疗关节软骨缺损,开创了应用自体软骨细胞移植治疗软骨损伤的新技术。该技术在1997年得到美国FDA正式批准后已在欧洲国家广泛使用,获得大量纯化且具有再生活力的软骨细胞是该技术的关键,但在实验过程中发现软骨细胞体外培养传代会发生去分化现象,丧失成软骨能力。
为了解决体外培养软骨细胞的去分化现象,越来越多的研究被报道,早在1975年就有实验证明胶原蛋白底物具有刺激成软骨的作用[2]。胶原也称胶原蛋白,是脊椎动物体内的一种结构蛋白,人体内含量非常丰富,占动物体胶原纤维固体物的 80%-90% ,占体内蛋白质总量的25%-30%,也是细胞外基质的主要成分[3]。由于胶原蛋白是天然的生物资源,来源广泛且具有独特的生物相容性、可降解性、低免疫原性,还有如高拉伸强度、止血性能及促进细胞生长等独特的性能,被越来越重视。由于胶原蛋白具有止血、促进组织再生和功能恢复的作用,被制成海绵、丝线、薄膜等医疗器械用于普外科、口腔、血管外科等多个科室,同时也因其组织相容性、可降解性被作为皮肤移植材料用于烧伤、创伤的修补。19世纪80年代,Zyderm胶原植入物被作为一种注射型胶原蛋白制剂在临床上开始使用,在治疗面部软组织变形方面已使用近30年[4]。人们成功将胶原蛋白制成各种各样的组织工程支架,如皮肤、骨组织、气管和血管支架,Award等[5]混合自体同源间叶细胞的茎状细胞和胶原蛋白凝胶制作肌腱用于腱后修复。
Wakitani等[6]用嵌入软骨细胞的胶原蛋白凝胶修复软骨缺
陷。胶原蛋白作为天然高分子生物材料已被证实可作为软骨组织工程支架材料,并且它作为底物能刺激软骨细胞生长,可用于体外软骨细胞培养,但关于不同类型胶原蛋白刺激成软骨作用的能力仍存在争议。本实验使用Ⅰ、Ⅱ型胶原包被培养板和普通培养板同时培养人软骨细胞,研究
Ⅰ、Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响。
材料和方法
设计:前瞻性实验。
时间及地点:于2008年1月至2009年4月在川北医学院附属医院风湿免疫研究所完成。
材料:收集川北医学院附属医院骨科因股骨颈骨折行
全髋置换20例患者的股骨头标本,患者年龄56-84岁,平均66岁。供者对实验均知情同意并签署知情同意书。
实验方法:
软骨细胞的分离及培养:将收集的关节软骨以体积分 数75%乙醇消毒后,用手术刀片刮除关节表面软组织及可能覆盖在其上的滑膜,再将关节表面软骨薄层组织削下来, 使削下的软骨组织尽量薄,不能削到软骨下骨。将收集的软骨组织片放入装有含青霉素(100 U/mL) 、链霉素(100 U/mL)的PBS中漂洗3次,洗去软骨表面血液及可能存在的滑膜,然后移入小玻璃瓶里,剪成1.0-2.0 mm3,在含双抗的PBS清洗后转入50 mL离心管内,加入0.2% Ⅱ型胶原酶2 mL消化。将消化后的软骨组织和液体通过200目金属筛网,将未消化的软骨组织残渣放入50 mL离心管中, 加入Ⅱ型胶原酶及DMEM继续消化,根据消化程度决定消化时间,但消化时间最长不超过12 h为宜。过滤得到的液体放入15 mL离心管中,1 000 r/min离心7 min,去上清, 加DMEM吹打,尽量轻柔,再次1 000 r/min离心7 min后弃去上清,反复清洗3次洗去Ⅱ型胶原酶。将锥虫蓝检测活力大于95%的原代软骨细胞以4×108 L-1浓度接种于25 cm2塑料培养培养瓶。待软骨细胞长满培养瓶85%以上,弃原培养液,PBS清洗3次,加2.0-3.0 mL含EDTA的0.25%胰酶
(以刚好覆盖培养瓶底为宜)消化2 min,镜下观察贴壁细胞变圆脱落,待细胞大部分脱落后,加入含胎牛血清的培养液终止消化。将消化下的细胞悬液用培养液混匀后移入15 mL离心管,1 000 r/min离心7 min,弃上清,加含体积分数10%胎牛血清的DMEM培养液制成细胞悬液,计数细胞,按1∶2接种于两个25 cm2培养瓶中,继续培养箱培养, 记录P0-P7代软骨细胞形态变化,使用选择培养后细胞形态正常、活性强的10组软骨细胞进行实验,选择开始出现去分化现象的P3代软骨细胞进行实验。
Ⅰ、Ⅱ型胶原蛋白培养板的制备:选择可用于包被培
养培养板的Ⅰ型(C3867,sigma)、Ⅱ型(C9301,sigma) 胶原蛋白,以1%浓度,按8 μg/cm2分别包被培养板记为Ⅰ 型板、Ⅱ型板。
不同培养板对软骨细胞生物学特性的影响及软骨细胞在3种培养板的体外扩增增殖速度:将P3代软骨细胞以2×107 L-1的细胞浓度分别接种于普通培养板、Ⅰ型板、Ⅱ 型板,放入孵箱继续培养10 d。
使用MTT法绘制细胞生长曲线,准备新的96孔板,在同一96孔板分3区,每一区32孔,按上述方法铺上胶原蛋白分别为Ⅰ型板、Ⅱ型板、普遍板。将第3代软骨细胞以
1×103接种于3区,每孔加入含胎牛血清、青霉素、链霉素
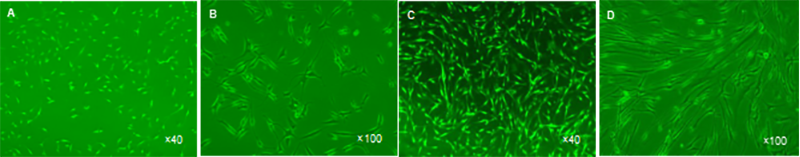
图 1 人软骨细胞的培养(倒置相差显微镜)
Figure 1 The culture of human cartilage cells (inverted phase contrast microscope)
图注:图中A、B 为第 3 代贴壁软骨细胞,以长椭圆形为主;C、D 为第 7 代贴壁软骨细胞,明显类似于成纤维细胞。
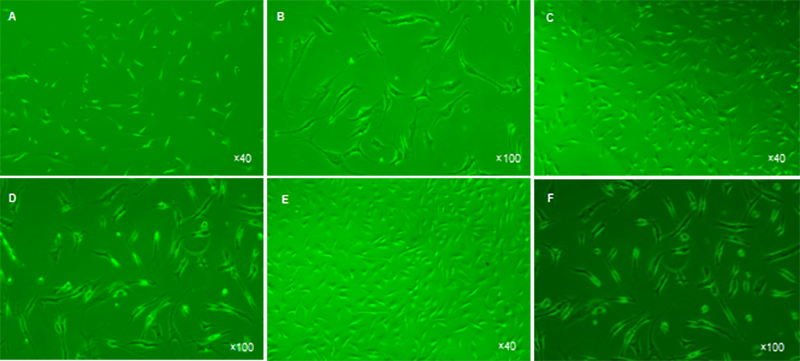
图 2 将人软骨细胞培养于不同培养板 10 d 后的细胞形态
Figure 2 Morphology of cartilage cells cultured in different culture plates for 10 days
图注:图中A、B 为普通培养板,细胞数量少,多为梭形,细胞出现较多分叉,细胞核不明显,无明显分裂增殖相;C、D 为Ⅰ型胶原蛋白包被培养板,细胞外观立体,表面胶原蛋白覆盖,细胞数多且细胞短于普通培养板,分叉细胞较少,具有分裂增殖能力;E、F 为Ⅱ型胶原蛋白包被培养板,细胞数量最多,外观立体,表面胶原蛋白覆盖,无明显分叉细胞,细胞核明显,具有较强的分裂增殖能力。
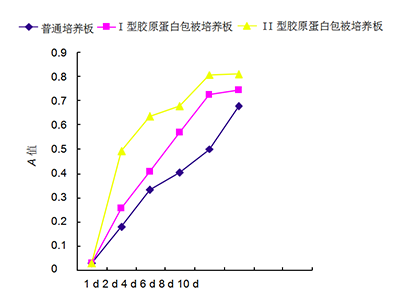 | 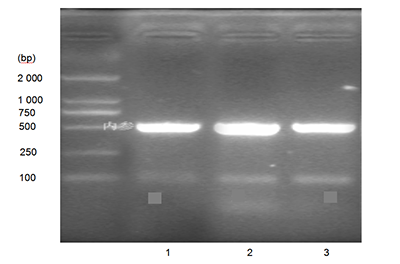 |
图 3 在不同培养板上培养人软骨细胞的生长曲线 Figure 3 Growth curves of human chondrocytes cultured in various culture plates 图注:第 2 天即进入对数生长期,Ⅰ、Ⅱ型胶原蛋白包被培养板中的软骨细胞增殖快于普通培养板,其中Ⅱ型胶原蛋白包被培养板中的软骨细胞增殖速度最快。在培养第 8 天时,Ⅰ、Ⅱ型胶原蛋白包被培养板中的软骨细胞增殖缓慢,进入平台期。培养第 10 天时Ⅱ型胶原蛋白包被培养板中软骨细胞仍多于另外两种培养板。 | 图 4 不同培养板中人软骨细胞培养上清液的Ⅱ型胶原基因表达量Figure 4 Type II collagen gene expression profile in cartilage cell culture supernatant of different plates 图注:图中 1 为普通培养板,2 为Ⅱ型胶原蛋白包被培养板,3 为Ⅰ 型胶原蛋白包被培养板。Ⅱ型胶原蛋白包被培养板中软骨细胞Ⅱ型胶原蛋白基因表达最高,Ⅰ型胶原蛋白包被培养板其次,最少的为普通培养板。 |
表 1 不同培养板中人软骨细胞培养上清液Ⅰ、Ⅱ型胶原蛋白,Ⅱ型胶原基因表达量及糖胺多糖的水平
Table 1 Type I and type II collagen protein, type II collagen gene
expression, and glycosaminoglycan contents in cartilage cell
| 组别 | Ⅰ型胶原蛋白(mg/L) | Ⅱ型胶原蛋白(mg/L) | Ⅱ型胶原基因表达量(灰度比值) | 糖胺多糖(mg/L) |
| 普通培养板组 | 308.42±50.85 | 69.88±5.48 | 0.33±0.09 | 1.31±1.23 |
| Ⅰ型胶原蛋白 | 165.03±69.32a | 85.97±10.34a | 0.63±0.08a | 3.37±1.64a |
| 包被培养班组 | ||||
| Ⅱ型胶原蛋白 | 118.09±45.73a | 97.46±9.39ab | 0.80±0.06ab | 4.55±0.87ab |
| 包被培养板组 |
表注:与普通培养板比较,aP < 0.01;与Ⅰ型胶原蛋白包被培养板组比较, bP < 0.01。结果显示Ⅱ型胶原蛋白包被培养板中软骨细胞分泌Ⅱ型胶原蛋白、糖胺多糖最多。
的培养液共200μL。放入37 ℃、体积分数5%CO2、95% 湿度的孵箱继续培养10 d,根据软骨细胞生长速度,检测2, 4,6,8,10 d软骨细胞吸光度值,每天各个区测4孔。每孔加入配置好的MTT 20 μL,继续放入孵箱培养4 h,终止培养后小心吸弃培养液,每孔加入DMSO 150 μL,摇床振荡10 min使结晶充分溶解,酶标仪选择570 nm检测吸光度值,绘制细胞生长曲线。
培养28 d后,采用ELISA法检测Ⅰ、Ⅱ型胶原蛋白含量,按ELISA试剂盒说明进行操作。在450 nm波长依序测量各孔的吸光度值(A值)。依据标准品浓度对应的A值计算出标准的直线回归方程,再根据样品的A值在回归方程上计算出对应的样品浓度。
培养28 d后,采用反转录-聚合酶链式反应测定Ⅱ型胶原蛋白基因表达。按照Trizol总RNA提取试剂说明书提取软 骨细胞总RNA,用凝胶电泳检测提取总RNA纯度,选择纯度较高的RNA使用反转录试剂盒进行反转录-聚合酶链式反应,根据GeneBank中Ⅱ型胶原cDNA序列,用Primier
5.0软件设计引物,由北京赛百盛基因有限公司合成。Ⅱ型胶原,上游引物:5-TCC TCT GCG ACG ACA TAA-3,下游引物:5-CAG TGG CGA GGT CAG TT-3。产物大小为108 bp,内参基因GAPDH为试剂盒自带。混匀标本,瞬时离心后放入PCR仪器中,设置参数为94 ℃预变性5 min, 94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,72 ℃ 再延伸5 min,共35个循环。选择1.5%琼脂糖凝胶进行电泳,根据凝胶自动成像分析仪扫描成像,观察电泳条带的灰度值,应用相应软件根据目的基因与内参照基因的条带灰度比值表达产物进行Ⅱ型胶原蛋白半定量分析。
培养28 d后,采用二甲基亚甲基蓝比色法定量检测糖胺多糖含量,按照试剂盒说明书操作进行。
主要观察指标:3种培养板中软骨细胞分泌Ⅰ胶原蛋 白、Ⅱ型胶原蛋白及糖胺多糖的量。
统计学分析:实验数据采用x±s
表示,采用SPSS 17.0
Hunter[7]认为软骨受到损伤无法修复,随着科学技术的
分析软件对实验数据进行处理,用单因素方差分析法和q 检验对数据进行检验,P < 0.01为差异有显著性意义。
结果 Results
2.1 倒置相差显微镜观察软骨细胞形态
软骨细胞培养:贴壁的原代软骨细胞呈椭圆形、多角 形;传代软骨细胞较原代细胞稍大,呈椭圆形、多角形或者不规则形;P3代软骨细胞和P1、P2代细胞相似,但细
胞逐渐伸展,变成以长椭圆形为主(图1A,B);传至P7代
软骨细胞明显类似于成纤维细胞(图1C,D)。
不同培养板培养的软骨细胞形态:培养10 d后,普通板中软骨细胞数量少,形态多为梭形,较细长(图2A);细胞出现较多分叉,细胞核不明显,无明显细胞分裂增殖相(图2B)。Ⅰ型板细胞表面被胶原蛋白纤维覆盖,细胞外观立体,细胞数多且细胞短于普通板(图2C),具有分叉的细胞较普通板少,分叉的细胞分支较少,60%细胞核明显, 具有分裂增殖能力(图2D)。Ⅱ型板软骨细胞数明显较多, 约长满培养板90%,且多为短小细胞,同Ⅰ型板细胞一样, 细胞外观立体,表面胶原蛋白覆盖(图2E),短小细胞占
2.2不同培养板中软骨细胞的增殖速度 观察细胞生长曲线(图3),第2天即进入快速生长的对数生长期。Ⅰ、Ⅱ 型板中的软骨细胞增殖快于普通板,其中Ⅱ型板中的软骨细胞增殖速度最快,为Ⅰ型板的2倍、普通板的5倍。在培养第8天时,Ⅰ、Ⅱ型板中的软骨细胞增殖缓慢,进入平台期,考虑细胞增殖快,接触抑制。由于Ⅱ型板中软骨细胞个体小于Ⅰ型和普通板,故培养第10天时Ⅱ型板中软骨细胞仍多于另外培养板。
2.3不同培养板对软骨细胞生物学特性的影响
软骨细胞分泌Ⅰ、Ⅱ型胶原蛋白水平及定量检测:3 种培养板中软骨细胞Ⅰ型胶原蛋白分泌量的差异均有显著性意义(P < 0.01,表1),再使用q检验进行两两比较显示, 普通板中软骨细胞分泌Ⅰ型胶原蛋白量高于Ⅰ、Ⅱ型板, 但不能认为Ⅰ、Ⅱ型板中软骨细胞分泌Ⅰ型胶原蛋白量不同。3种培养板中软骨细胞Ⅱ型胶原蛋白分泌量差异有显著性意义(P < 0.01),使用q检验进行两两比较后,显示Ⅰ、
Ⅱ型板中软骨细胞分泌Ⅱ型胶原蛋白量均高于普通板,其中Ⅱ型板中软骨细胞分泌Ⅱ型胶原蛋白量最高。根据半定量PCR检测也得出Ⅱ型板中软骨细胞Ⅱ型胶原蛋白基因表达最高,Ⅰ型板其次,最少的为普通板(图4)。
软骨细胞分泌糖胺多糖的量:3种培养板中软骨细胞糖
胺多糖分泌量差异有统计学意义(P < 0.01),使用q检验进行两两比较后显示,Ⅰ、Ⅱ型板中软骨细胞分泌糖胺多糖都高于普通板,其中Ⅱ型培养板中软骨细胞分泌量最高(表1)。
讨 论 Discussion
Hunter认为软骨受到损伤无法修复,随着科学技术的发展和组织工程学的兴起,对关节软骨缺损的修复取得了一定进展,从促进软骨修复逐渐发展到促进软骨重建,如何获
得足量的健康种子细胞及支架材料仍是研究的关键所在。获得足量的种子细胞主要通过体外培养,软骨细胞仍然
是研究的主要细胞[8],目前软骨细胞的体外研究主要集中在兔关节软骨细胞的培养及诱导成模,动物的骨细胞往往增生活跃,并且由于种属间差异,只能从一定程度上说明研究的意义,本实验选择直接从临床上获得的人关节软骨细胞进行研究,更符合人实际生理状态,更能指导临床应用。关节软骨细胞成分较单一,通过消化分离可以获得高纯度的软骨细胞[9]。本实验根据Tew等[10]报道使用DMEM配置的0.2%Ⅱ型胶原酶一步法消化软骨组织获得软骨细胞,避免了多种酶对软骨细胞的毒性,同时获得大量具有活力的软骨细胞。通过实验发现软骨细胞经过3次传代后逐渐失去其原来的形态, 出现去分化现象,这与报道相同[11-13],Watt [14]认为,软骨细胞梭形变与细胞表型上的去分化有关,是判断软骨细胞表型是否改变的主要指标,选择开始有去分化趋势的P3代软骨细胞进行实验,能了解不同培养板对软骨细胞去分化趋势的影响。如何利用少量软骨组织获得多数量、高活性、具有分化能力的种子细胞,是目前关节软骨组织工程制备技术中的重要问题之一[15-16]。
对去分化软骨细胞再次恢复增殖活性和细胞表型的能力即再分化进行了研究,将已经去分化的软骨细胞加入三维立体空间培养可以维持甚至恢复细胞的特性[17]。如何将单层培养获得软骨细胞与三维立体空间相结合培养软骨细胞,值得深入讨论[18]。应用于关节软骨修复重建的材料主要有人工合成材料(PGA、PLA、PLGA等)、天然材料(胶原蛋白、琼脂糖、海藻酸钠等)[19-22],其中天然材料胶原蛋白凝胶[23]、胶原蛋白海绵应用广泛[24]。但在临床研究中发现软骨细胞在Ⅰ型胶原蛋白中仍会发生去分化现象,最终形成纤维软骨,而非透明软骨;环境因素对维持软骨细胞的表型至关重要[25-26],研究发现软骨细胞基质中最多的Ⅱ 型胶原蛋白能维持软骨细胞的形态,增进Ⅱ型胶原蛋白及聚合素的合成[27-28],同时发现软骨细胞在Ⅱ型胶原蛋白凝胶里分泌糖胺多糖及细胞因子增加。
本实验在相同条件下比较了普通板、Ⅰ型胶原蛋白包被板、Ⅱ型胶原蛋白包被培养板对软骨细胞体外培养的影响, 了解Ⅰ、Ⅱ型胶原蛋白哪种更能维持细胞活性和表型,使细胞大量扩增。通过细胞计数发现,随着软骨细胞传代次数增加,同等面积收获软骨细胞数逐渐减少,考虑因细胞增殖活性减低,而且随着去分化现象的出现,细胞伸展,变为细长, 增加了每个细胞所占面积,细胞的接触抑制也使单位面积细胞数减少。高浓度细胞培养有益于细胞表型的维持[30]。胶原蛋白与细胞有交互作用,能帮助细胞聚集贴附,故胶原包被培养板贴壁细胞多,胶原蛋白和软骨细胞相结合形成许多交错网状结构,在镜下观察可见软骨细胞镶嵌于胶原蛋白中。观察细胞形态及增殖速度可以看出,Ⅱ型胶原蛋白包被培养板中软骨细胞较Ⅰ型胶原蛋白包被培养板中软骨细胞形态小、分叉细胞少、具有分裂增殖活性的细胞多,增殖速度明显快于另两个培养板。
细胞外基质是软骨细胞生长和代谢的场所,同时软骨细胞也能合成和分泌细胞外基质,是评价细胞生物学功能活性的主要指标[31-32]。Ⅱ型胶原蛋白和蛋白多糖是两大特异性基质成分[33-34],可以通过检测其含量来判断软骨细胞是否具有分化能力。由于软骨细胞发生去分化现象时分泌Ⅰ型胶原蛋白而不是Ⅱ型胶原蛋白[35-37],可以通过测量软骨细胞分泌Ⅰ 型胶原蛋白的量来了解软骨细胞的去分化趋势。通过ELISA 检测发现,普通培养板中软骨细胞分泌以Ⅰ型胶原蛋白为主,提示经过3次传代体外培养的软骨细胞开始出现去分化趋势。P3代软骨细胞在Ⅰ、Ⅱ型胶原蛋白包被培养板中继续培养后分泌Ⅰ型胶原蛋白的量明显少于普通板,其中Ⅱ型胶原蛋白包被培养板中Ⅰ型胶原蛋白分泌量为普通板的一半,提示两种胶原蛋白均能延长软骨细胞出现去分化现象的时间,而该作用在Ⅰ、Ⅱ型胶原蛋白之间比较没有明显差异。
Ⅰ、Ⅱ型胶原蛋白包被培养板中软骨细胞分泌Ⅱ型胶原蛋白明显多于普通板,其中以Ⅱ型胶原蛋白包被板明显,提示有去分化趋势的软骨细胞在胶原包被培养板(特别是Ⅱ型胶原 蛋白)中继续培养后,软骨细胞分化能力强于普通板,说明Ⅱ 型胶原蛋白包被培养板能增强软骨细胞继续分化增殖的能力。本实验中有去分化趋势的软骨细胞接种于胶原包被培养板继续培养后,虽然软骨细胞分泌Ⅱ型胶原蛋白明显增加, 但仍是以分泌Ⅰ型胶原蛋白为主,提示细胞的再分化只有经过长时间培养才会完成,与Binette等[38-39]研究相同。
本实验发现胶原蛋白和软骨细胞有交互作用,胶原蛋白包被的培养板应用于原代软骨细胞体外培养时能使细胞尽早贴壁,减少悬浮死细胞量。胶原蛋白包被培养板培养软骨细胞优于普通培养板,其中Ⅱ型胶原蛋白包被培养板在培养软骨细胞时更能维持细胞形态,延长去分化现象出现的时间,更利于细胞再分化。实验为后期进行软骨细胞在Ⅱ型胶原蛋白凝胶里进行三维立体培养,甚至软骨细胞-Ⅱ型胶原蛋白凝胶复合物临床实验奠定了基础。
致谢:感谢川北医学院附属医院风湿免疫研究所提供实验室及实验室老师提供的实验技术支持。
作者贡献:蔚芃进行实验设计、审校稿件,蒋萍完成了资料收集、实验实施及最终成文,对文章负责,赵明才完成了实验评估及实验技术指导,陈琼、王梓帮助完成了实验数据统计、分析。
利益冲突:文章及内容不涉及相关利益冲突。
伦理要求:采用川北医学院附属医院骨科行人工股骨头置换 后丢弃的股骨头标本进行实验,患者均知情,川北医学院附属医院为三级甲等医院,具有完成该手术及进行实验的条件、资质。学术术语:胶原蛋白-是脊柱动物含量最多、分布最广的蛋白
质,在体内具有广泛的生物学活性;体外应用具有低免疫原性、良好的生物相容性、可降解性、可参与组织修复重建等优越性, 是最重要的天然可降解的生物医用材料。
作者声明:文章为原创作品,无抄袭剽窃,无泄密及署名和
专利争议,内容及数据真实,文责自负。
参考文献
[1]Brittberg M,Lindahl A,Nilsson A,et al.Treatment of deep cartilage defects in the Knee with autologous chondrocytes transplantation.N Engl J Med. 1994;331(14):889-895.
[2]Kosher RA, Church RL. Stimulation of in vitro somite chondrogenesis by procollagen and collagen. Nature. 1975;258(5533):327-330.
[3]Shouldes MD,Raines RT.Collagen structure and stability.Annu Rev Biochem.2009;78:929-958.
[4]顾其胜.胶原蛋白的临床应用[J].中国修复重建外科杂志, 2006, 20(10):1052-1057.
[5]Award H, Butler DL,Boivin GP,et al.Autologous mesenchymal stem cell-mediated repair of tendon.Tissue Eng. 1999;5(3): 267-277.
[6]Wakitani S,Goto T,Young RG,et al.Repair of large fullthickness ar-ticular cartilage defects with all graft articular chondrocytes embedded in a collagen gel.Tissue Eng.1998;4(4):429-444.
[7]Hunter W.Of the structure and diseases of articulating cartilages. Clin orthop Relat Res.1995;(317):3-6.
[8]Schulz RM,Bader A.Cartilage tissue engineering and bioreactor systems for the cultivation and stimulaion of chondrocytes.Eur Biophys J.2007;36(4-5):539-568.
[9]Buckwalter JA,Mankin HJ.Articular cartilage: tissue design and chondrocyte matrix interactions.AAOS Inst Course Lect. 1998;47(3):477-486.
[10]Tew SR,Murdoch AD,Rauchenberg RP,et al.Cellular methods in cartilage research: primary human chondrocytes in culture and chondrogenesis in human bone marrow stem cells. Methods.2008;45(1):2-9.
[11]Outerbridge HK,Outerbridge RE,Smith DE.Osteochondral defects in the knee, A treatment using lateral patella autografts.Clin Orthop Relat Res.2000;37(7):145-151.
[12]Shapiro F,Koide S,Glimcher MJ.Cell origin and differentiation in the repair of full-thickness detects of articular cartilage.J Bone Joint Surg Am .1993;75(4):532-553.
[13]Schulze-Tanzil G,de Souza P,Villegas Castrejon H,et al.Redifferentiation of dedifferentiated human chondrocytes in high-density cultures.Cell Tissue Res. 2002;308(3):371-379.
[14]Watt F. Effect of seeding density on stability of the dedifferentiated phenotype of pig articular chondrocytes in culture.J Cell Sci.1988;89:373-378.
[15]Temenoff JS,Mikos AG.Review: tissue engineering for regeneration of articular cartilage. Biomaterials. 2000;21(3):431-440.
[16]Nerem RM,Sambanis A.Tissue engineering : from biology to biological substitutes.Tissue Eng.1995;1(1):3-13.
[17]Benya PD,Shaffer JD.Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels.Cell. 1982;30(1):215-224.
[18]Kuriwaka M,Ochi M,Uchio Y,et al.Optimum combination of monolayer and three-dimensional cultures for cartilage-like tissue engineering.Tissue Eng.2003;9(1):41-49.
[19]Pieper JS,Vander Kraan PM,Hafmans T,et al.Crosslinked type II collagen matrices:preparation,characterization,and potential for cartilage ngineering.Biomaterials.2002;23(15):3183-3192.
[20]Van Beuningen HM,Stoop R,Buma P,et al.Phenotypic differences in murine chondrocyte cell lines derived from mature articular cartilage.Osteoarthritis Cartiage. 2002; 10(12): 977-986.
[21]Ushida T,Furukawa K,Toita K,et al.Three-dimensional seeding of chondrocytes encapsulated in collagen gel into PLLA scaffolds.Cell Transplant.2002;11:489-494.
[22]Ma,HL,Hung,SC,Lin SY,Chen YL,et al.Chonderogenesis of human mesenchymal stem cells encapsulated in alginate beads.J Biomed Mater Res.2003;64(2):273-281.
[23]Kimura T,Yasui N,Ohsawa S,et al.Chondrocytes embedded in collagen gels maintain cartilage phenotype dur ing long term cultures.Clin Orthop Relat Res. 1984;(186):231-239.
[24]Speer DP,Chvapil M,Volz R,et al.Enhancement of healing in osteochondral defects by collagen sponge implants.Clin Orthop Relat Res.1979;(144):326-335.
[25]Ito Y,Ochi M,Adachi N,et al.Repair of osteochondral defect with tissue-engineered chondral plug in a rabbit model. Arthroscopy.2005;21(10):1155-1163.
[26]Darting EM,Athanasiou KA.Retaining zonal chondrocyte phenotype by means of novel growth environments.Tissue Eng.2005;11(3-4):395-403.
[27]Qi WN,Scully SP.Extracelluar collagen regulates expression of transforming growth factorth factor-betal gene.J Orthop Res.2000;18:928-932.
[28]Qi WN,Scully SP.Effect of type II collagen in chondrocyte response to TGF-beta1 regulation.Exp Cell Res. 1998;241(1): 142-150.
[29]Qui W,Scully S.Extracellular collagens demonstrate a type specific influence on cytokine regulation of articular chondrocytes.Proc of the ORS, Atlanta, GA; 1996:308.
[30]Tew SR,Murdoch AD,Rauchenberg RP,et al.Cellular methods in cartilage research: primary human chondrocytes in culture and chondrogenesis in human bone marrow stem cells. Methods.2008;45(1):2-9.
[31]周强,李起鸿,戴刚.骺板软骨细胞复合三维支架体外构建组织工程软骨的研究[J].中国修复重建外科杂志,2004,18(2):92-95.
[32]林建华,陈晓东,邓凌霄,等.大鼠软骨细胞复制性老化的体外观察
[J].中国修复重建外科杂志,2007,21(11):1228-1232.
[33]周强,李起鸿,戴刚.三步酶消化法高效分离兔原代关节软骨细胞及体外培养观察[J].中华外科杂志,2005,43(8):522-526.
[34]Sandell LJ,Sugai JV,Trippel SB.Expression of collagens Ⅰ, Ⅱ, Ⅹ,and Ⅺ and aggrecan mRNAs by bovine growth plate chondrocytes insitu.J Orthop Res.1994;12(1):1-14.
[35]Miot S,Woodfield T,Daniels AU,et al. Effects of scaffold composition and architecture on human nasal chondrocyte redifferentiation and cartilaginous matrix deposition. Biomaterials.2005;26(15):2479-2489.
[36]张艳,柴岗,刘伟,等.体外培养过程中去分化的人软骨细胞基因表达谱的变化[J].中华整形外科杂志,2007,23(4):331-334.
[37]Karlsen TA,Shahdadfar A,Brinchmann JE.Human primary articular chondrocytes, chondroblasts-like cells, and dedifferentiated chondrocytes: differences in gene, microRNA,and protein expression and phenotype.Tissue Eng Part C Methods. 2011;17(2):219-227.
[38]Binette F,McQuaid DP,Haudenschild,DR,et al.Expression of a stable articular cartilage phenotype without evidence of hypertrophy by adult human articular chondrocytes in vitro.J Orthop Res.1998;16:207-216.
[39]Liu H, Lee YW, Dean,MF. Re-expression of differentiated proteoglycan phenotype by dedifferentiated human chondrocytes during culture in alginate beads.Biochim Biophys Acta.1998;1425:505-515.
“以上内容为营养科普知识,仅供消费者参考学习。相关内容不代表产品功效,请消费者理性阅读。”
